一、口罩的分类
由于大家基本是器械从业者,今天我们着重聊的是医用口罩。
1、根据《医疗器械分类目录》,医用口罩有2种,如下图:
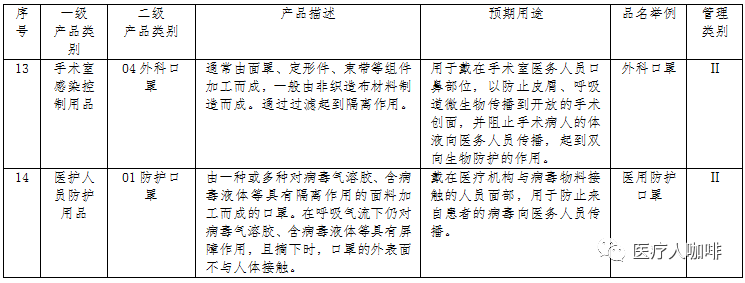
2、根据国家局《医用口罩产品注册技术审查指导原则》,以产品的预期用途和适用范围为依据,一般分为医用防护口罩、医用外科口罩和一次性使用医用口罩。
医用防护口罩适用于医务人员和相关工作人员对经空气传播的呼吸道传染病的防护。
医用外科口罩适用于医务人员或相关人员的基本防护,以及在有创操作过程中阻止体液和喷溅物传播的防护。
一次性使用医用口罩适用于佩戴者在不存在体液和喷溅风险的普通医疗环境下的卫生护理。
由此我们可以看出,医用口罩全部属于二类医疗器械,如果要做口罩生产,必须进行相应设计研发,在符合GMP的条件下生产样品,并按《医疗器械注册管理办法》进行编写产品技术要求,送注册检验、准备注册资料,进行产品注册,由于其在免临床目录中,所以不需要做临床试验,但需进行临床评价,提交申报产品与已上市同类产品的对比说明。对比说明应当包括工作原理、产品材质、结构组成、主要技术性能指标、消毒/灭菌方法、预期用途、是否家庭使用等内容。
二、医用口罩的组成结构
医用口罩一般由熔喷布、无纺布、口罩带、鼻夹组成,其中外层和内层均采用无纺布、中层采用熔喷布。口罩最外层具有防飞沫设计,中间层是核心功能层,用于过滤飞沫、颗粒或细菌,内层主要吸湿。
主体过滤材料为聚丙烯熔喷布,是一种超细静电纤维布,由于静电作用可以捕捉粉尘,含有各类病毒的飞沫接近聚丙烯熔喷布后,能被吸附在熔喷布表面,无法穿透。适合平面口罩熔喷过滤级别有:普通级、BFE95(滤效95%)、BFE99(滤效99%)、VFE95(滤效99%)、PFE95(滤效99%)、KN90(滤效90%)。熔喷布一般选用20克重,克重越高,防护过滤效果越好,N95的采用40克重甚至更高。当然,如果无纺布层过多,口罩就比较硬,而熔喷层过多,则呼吸比较困难,
其他材料:金属(用于鼻夹)、染色剂、弹性材料(用于口罩带)等。
三、医用口罩工作原理
医用口罩大部分为自吸式过滤口罩,其工作原理是使含有害物的空气通过口罩的滤料过滤后再被人吸入或者呼出。口罩滤料的过滤机理主要有以下几种(见图2):

图2 滤料纤维过滤机制示意图
1. 扩散沉积:粒子布朗运动扩散位移到过滤纤维,受分子引力作用而被吸附。最易捕捉小尺度粒子、细纤维和低速运动的粒子。
2. 截留沉积:随气流运动的较大粒子被过滤材料的机械筛滤作用截留。粒子直径与滤膜纤维的直径的比率影响拦截效率。
3. 惯性沉积:粒子通过过滤材料弯曲的网状通道时,粒子由于惯性作用脱离气流撞击过滤纤维,并受分子引力作用被截留。大粒子、高密度、速度快时截留效果好。
4. 静电吸引沉积:粒子被过滤纤维的静电作用产生的沉积。
颗粒越小时,1、4沉积效应越强,颗粒越大时,2、3效果越好,所以并非越小的颗粒越难被过滤。综合4种过滤机制的协同作用,普通机械性滤料最易穿透粒径的范围是0.1µm~0.3µm。
四、医用口罩适用的相关标准
医用口罩产品应根据自身特点适用以下标准,但不限于引用以下标准:
相关产品标准
|
标准编号 |
标准名称 |
|
GB/T 1.1-2009 |
标准化工作导则 第1部分:标准的结构和起草规则 |
|
GB/T 191-2008 |
包装贮运图示标志 |
|
GB/T 2828.10-2010 |
计数抽样检验程序 第10部分:GB/T 2828计数抽样检验系列标准导则 |
|
GB/T 14233.1-2008 |
医用输液、输血、注射器具检验方法 第1部分:化学分析方法 |
|
GB/T 14233.2-2005 |
医用输液、输血、注射器具检验方法 第2部分:生物学试验方法 |
|
一次性使用卫生用品卫生标准 |
|
|
一次性使用医疗用品卫生标准 |
|
|
GB/T 16886.1-2011 |
医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5-2003 |
医疗器械生物学评价 第5部分:体外细胞毒性试验 |
|
GB/T 16886.7-2001 |
医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 |
|
GB/T 16886.10-2005 |
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
|
医疗器械 环氧乙烷灭菌确认和常规控制 |
|
|
医疗保健产品灭菌确认和常规控制要求 辐射灭菌 |
|
|
医用防护口罩技术要求 |
|
|
最终灭菌医疗器械的包装 |
|
|
YY/T 0466.1-2009 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |
|
YY 0469-2011 |
医用外科口罩 |
|
YY/T 0615.1-2007 |
标示“无菌”医疗器械的要求 第1部分:最终灭菌医疗器械的要求 |
|
YY/T 0969-2013 |
一次性使用医用口罩 |
|
中华人民共和国药典二部(2010版) |
其中:
2. 医用外科口罩:应符合YY 0469-2011《医用外科口罩》;
3. 一次性使用医用口罩:应符合YY/T 0969-2013《一次性使用医用口罩》要求。
具体详见下图:

五、医用口罩生产流程及设备
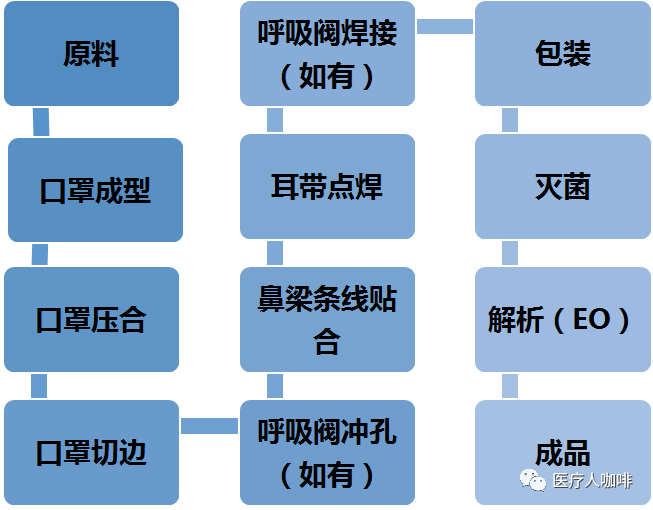
医用口罩一般为无菌,其中一次性使用医用口罩有无菌和非无菌两种,其他医用口罩均为无菌产品,都应在10万级无菌洁净厂房生产,其厂房要求较为苛刻,应有空调净化系统、纯化水系统在从原料进厂,需经过口罩成型、压合、切边、呼吸阀焊接(如有)、耳带点焊、鼻梁条线贴合、呼吸阀冲孔(如有)、包装、灭菌、解析(EO灭菌)方可制造完成。

全自动一拖二口罩生产设备
为实现以上制造过程,需配置全自动生产设备或半自动生产设备。全自动设备是一体成型,一般1台本体机拖2到3台耳带机,从原料投料到包装完成都可实现。而半自动设备则需按以上流程逐个配置,包括口罩成型机、口罩压合机、口罩切边机、呼吸阀冲孔机、鼻梁条线贴合机、耳带点焊机、呼吸阀焊接机等。
六、医用口罩的灭菌
对于生产的医用无菌口罩,必须通过灭菌工序方可放行。对于跨界进行入口罩行业,这无疑是个门槛。灭菌可以通过委托灭菌,也可以购买灭菌设备自行灭菌。市面上一般由环氧乙烷(EO)灭菌和辐照灭菌两种方式。考虑到辐照灭菌剂量控制不好会对熔喷布带来影响导致过滤效率不符合要求,所以绝大部分企业都选用EO灭菌。由于EO灭菌使用的是有毒有害的环氧乙烷,所以灭菌后还需进行解析,分为自然解析和灭菌柜解析。一般而言,自然解析的周期约为14天,才能确保口罩中残留的环氧乙烷达标。
七、医用口罩的检测要求
医用口罩产品的检测包括出厂检验和型式检验。
出厂检验项目至少应有以下项目:外观、结构与尺寸、鼻夹、口罩带、微生物指标、环氧乙烷残留量(若采用环氧乙烷灭菌)的要求。
型式检验应为产品标准的全性能检验。
相关口罩主要性能指标为:
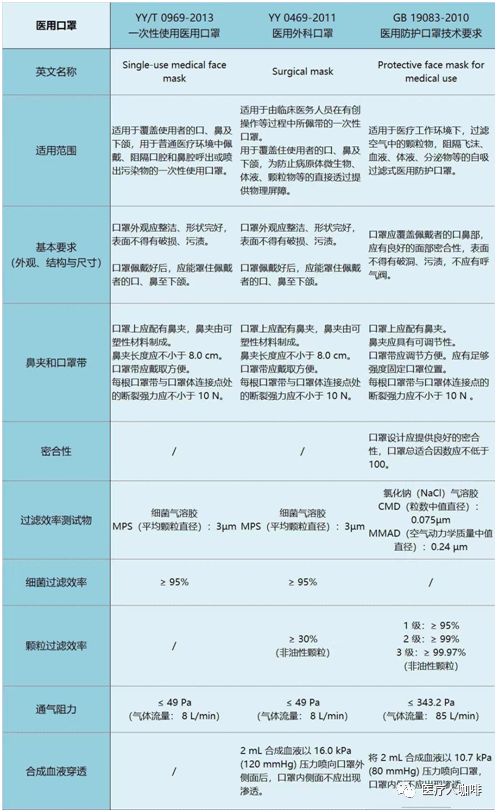
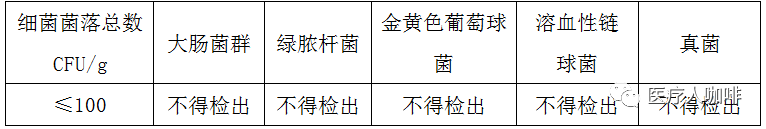
关于微生物指标,灭菌口罩经环氧乙烷灭菌,应无菌,其环氧乙烷的残留量应不超过 10μg/g。对于非灭菌口罩(普通级)应符合下表的要求。
口罩微生物指标
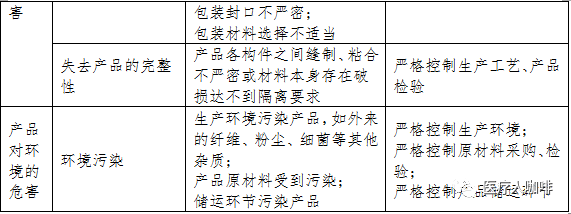
八、医用口罩存在的主要风险
医用口罩产品在进行风险分析时应符合YY/T0316-2008《医疗器械 风险管理对医疗器械的应用》的要求。企业在进行风险分析时,至少应考虑表中的主要危害,企业还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。
产品主要危害表

九、医用口罩其他相关问题
1、鉴于目前对医用口罩的过滤材料质量难以通过便捷有效的检验方式来控制,生产质量管理体系的规范运行是企业保证口罩产品质量稳定的主要手段,故在注册技术审评和体系考核中审核员和检查员会关注过滤材料的生产工艺及供货来源。企业应对产品的过滤材料进行控制,明确过滤材料的来源及质量要求,具有相对稳定的生产工艺及供货来源以保证产品的质量。
2、医用口罩是二类医疗器械,理应走注册程序。在疫情条件下,部分省份可以进行备案管理,各省明确对于在一级响应期间新增拟开展医用口罩、防护服等属于二类防控器械产品注册和生产的,凭工信部门意见向所在地市药监局申请备案,市局在备案凭证中应注明“本备案仅在公共卫生事件一级响应期间适用”。备案后,按以下方法放行:按照《中国药典》(2015年版)第三部1101无菌检测法开展无菌检验,在培养七天后未发现有微生物生长,其他理化指标均检测合格,可先放行。产品标签上应按照正常无菌检测完成时间标注使用的起始时间。企业在无菌检验后续培养观察时间内,发现不符合要求的,应及时召回










